(2022年1月更新)
肝臓は様々な代謝機能を持つ臓器であり、多くの治療薬は肝臓で代謝される。生じた代謝産物が細胞障害性の物質である可能性があるため、新規治療薬開発の過程では必ず肝細胞を使った毒性試験が必要である。しかしながら、凍結肝細胞や肝癌細胞を用いた試験では、長期培養が困難であったり、十分な代謝機能を誘導できないなどの問題点があった。また、胆汁排泄路が存在しないために、生体内と同様な代謝産物の動態を検討することができなかった。我々は肝細胞機能の長期維持と肝臓組織内での胆汁輸送を再現するために、肝細胞が形成する毛細胆管と胆管が接続した新規肝臓オルガノイド構築を目指した。
小型肝細胞と胆管上皮細胞の共培養によるHepatobiliary connection形成
肝細胞をMatrigel内に埋入するとスフェロイドを形成し、細胞間に毛細胆管様構造を形成するが、連続したネットワークは構築出来ない。また胆管上皮細胞をコラーゲンゲルでサンドイッチして培養すると3次元的な管腔網を形成することが知られている。
成熟正常マウス肝臓から小型肝細胞(SHs)を分離培養した。増殖したSHsにMatrigelを投与すると、成熟化して細胞間に毛細胆管様構造(BCs)を形成する。しかしながら、BCの管腔が連続するネットワークは構築できない。EpCAM陽性胆管上皮細胞(BECs)をI型コラーゲンゲル上で培養し、コラーゲンゲルを重層するサンドイッチ培養を行うとネットワーク状の管腔構造を形成する(図1)。
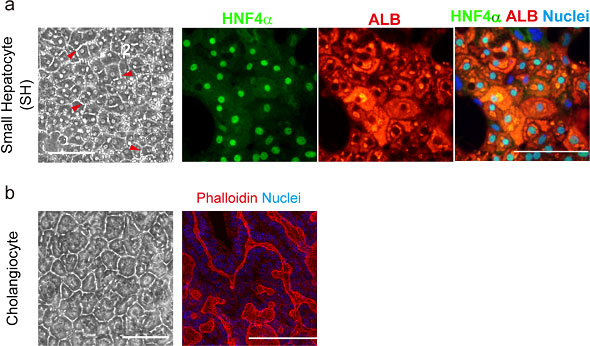
図1. マウス小型肝細胞(SHs)と胆管上皮細胞(BECs)の培養。Matrigel投与によるSHsの成熟化誘導(a)とBECsのコラーゲンゲルサンドイッチによる管腔形成(b)。
毛細胆管と胆管を同時に誘導することで、両者が接続することを期待し、コラーゲンゲル上にSHsとBECsを同時に播種して共培養した。しかしながら、20%Matrigelを含んだコラーゲンゲルを重層しても、SHsとBECsが結合することは無かった。
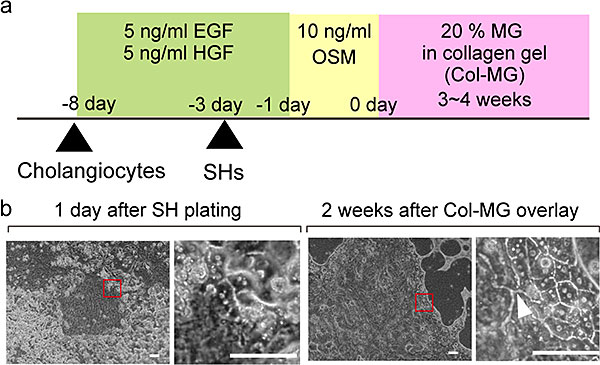
図2. BECsとSHsの共培養によるHepatobiliary connectionの形成。コラーゲンゲル上にBECsを播種しコロニー形成した5日後にSHsを播種し共培養する。2日間培養後にOncostatin M (OSM)を投与し、その1日後に20%Matrigelを含んだコラーゲンゲル(Col-MG)を重層し培養を継続する(a)。重層後4週間培養した細胞。肝細胞(HNF4α+)と胆管上皮細胞(CK19+)が接した所に形成されたHepatobiliary connection (c)。肝細胞間に形成された毛細胆管(右上)が、BECsからなる胆管(右下)が、肝細胞とBECsからなる部分(右中図)で連続している。
次に、BECsのみを最初に播種し、コロニーを形成した後にSHを播種することにした。BECコロニー間のempty spaceにSHsは接着し、1日後にはBECsと接するようになる(図2b左図)。隣接するBECsとSHs間にはタイト結合が形成されていた。
Col-MG重層後2週間培養するとSHsは成熟化し、広い細胞質と円形な核を持つ肝細胞になり、細胞間には連続した毛細胆管が形成される(図2右図)。BECsも胆管構造を形成し、肝細胞が形成する毛細胆管と胆管の管腔が結合した部分が顕微鏡下に認められるようになる(図2b;矢頭)。
重層後4週間培養した細胞でBECsからなる胆管と毛細胆管の接合部を詳細に観察した(図2c)。肝細胞(HNF4α+)が形成する毛細胆管(右上;矢頭)が、肝細胞とBECs(CK19+)に囲まれた管腔(右中;矢頭)につながり、BECs(CK19+)のみからなる胆管(右下;矢頭)と連結していることが分かった。管腔面はactin-rich (Phalloidin+)であり、収縮能があると推測できる。
我々はこの肝細胞と胆管の接続部を再現したオルガノイドをHepatobliary Tubular Organoid (HBTO)と名付けた。
接続部構造(Hepatobiliary connection)の頻度を計測した。肝細胞と胆管上皮細胞の接触部分1 mm長間に3.2±0.4個の接続部構造を認めた(図3)。
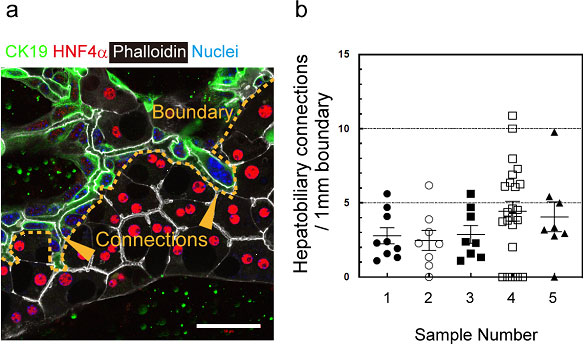
図3. 肝細胞(HNF4α+)とBECs (CK19+)の接触部(Boundary)の長さ当たりのHBTOの数。
接続部構造を形成する細胞が、肝細胞(CEACAM+)、BECs (Ezrin+)あるいはどちらの性質も兼ね備えたintermediate 細胞であるか検討した(図4)。
肝細胞(CEACAM+)とBECs (Ezrin+)が直接相互作用しており、両細胞の性質を兼ね備えた中間的な細胞は認めなかった。
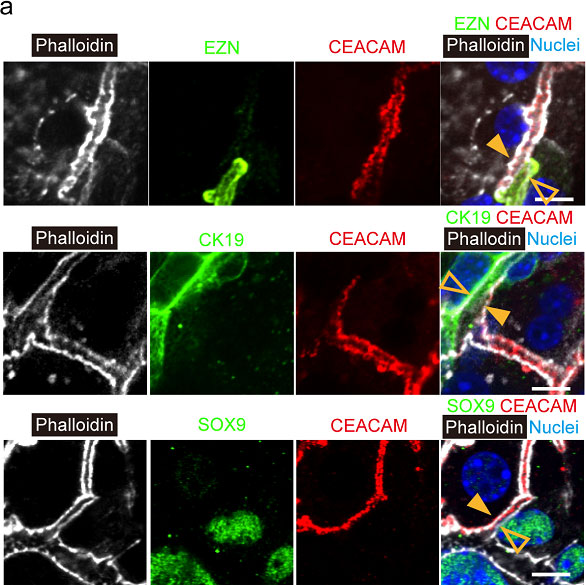
図4. 肝細胞膜マーカー(carcinoembryonic antigen-related cell adhesion molecule, CEACAM)と胆管上皮細胞マーカーであるEzrin (EZN)/CK19/Sox9を用いた蛍光染色像。
成熟マウス肝臓においても同様に、肝細胞(CEACAM+)とBECs (Ezrin+)が直接相互作用しており、中間的な細胞は見られない(図5)。
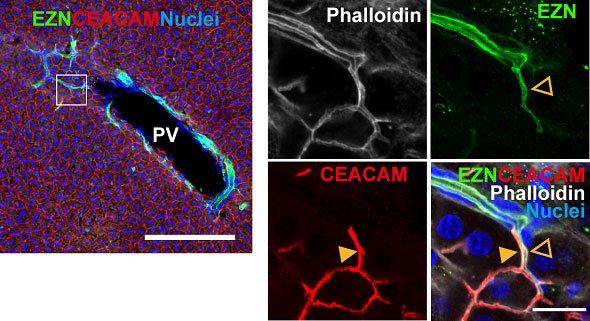
図5. 成熟マウス肝臓におけるHBTO。肝細胞(CEACAM+)と胆管上皮細胞(EZN+)の接合部(左図)と白線で囲った部分の拡大図(右図)。
接合部の約60%は、1つずつの肝細胞と胆管上皮細胞からなり、他は肝細胞1つに2ないし3個の胆管上皮細胞で形成されていた(図6)
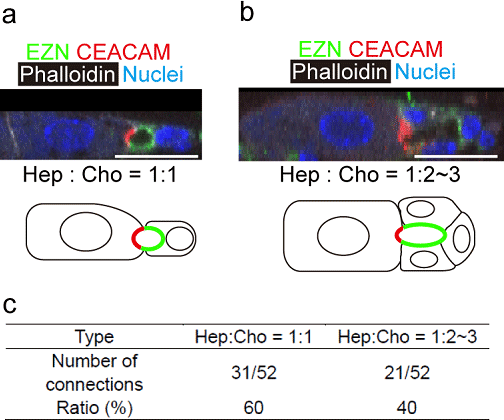
図6. HBTOを構成する肝細胞(CEACAM)と胆管上皮細胞(EZN)の比率。
SHsがBECsに、またBECsが肝細胞に分化転換する可能性について検討した。肝細胞にtdTomatoを発現させたマウスから細胞を分離し、野生型BECsと共培養しHBTOを形成させた(図7)。
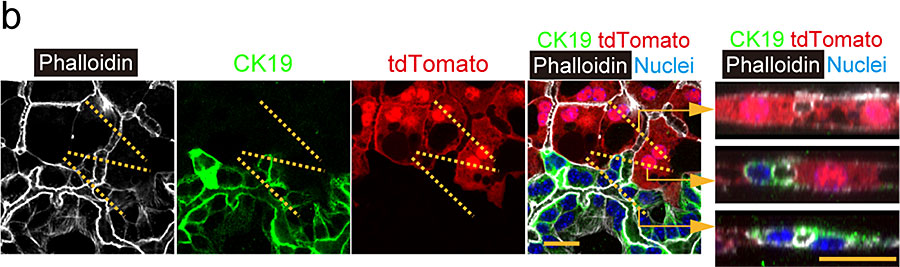
図7. CAG-Cre:ROSA-tdTomato マウスから分離したSHsと 野生型マウスから分離したEpCAM陽性 BECsを共培養し、形成されたHBTOの蛍光免疫染色像。
tdTomato陽性CK19陰性肝細胞とtdTomato陰性CK19陽性BECsが管腔構造を形成していたが、tdTomato陽性BECsやtdTomato陰性肝細胞は認められなかった。
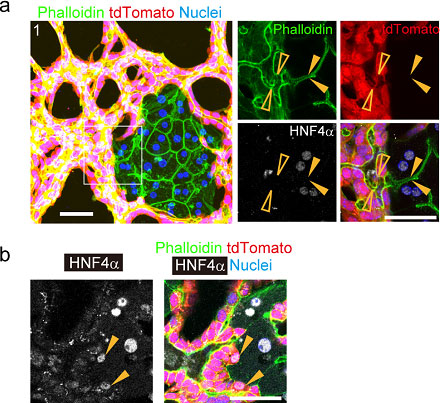
図8. CAG-Cre:ROSA-tdTomato マウスから分離したBECsと 野生型マウスから分離したSHsを共培養し、形成されたHBTOの蛍光免疫染色像。
図8で示すようにCAG-Cre:ROSA-tdTomato マウスから分離したBECs(tdTomato+)と野生型マウスのSHsで形成されたHBTOの一部に、HNF4α+を弱く発現する核を持つtdTomato+BECs(0.7%)が認められた。しかしながら、tdTomato+肝細胞もtdTomato–BECs どちらの細胞も認められなかった。
HBTOにおいて、肝細胞と胆管が機能的に接続し、肝細胞の代謝物が毛細胆管に排泄され胆管に運ばれるかを検討した。まず、コントロール実験として、Chloromethylfluorescein diacetate (CMFDA)を培養液に加え、CMFDAが肝細胞内で代謝されること、BECsがCMFDAを代謝できないことを確認した(図9左図)。
次に、HBTOを形成した細胞培養液にCMFDAを加えた。代謝産物であるfluoresceinが毛細胆管に排泄され胆管に移行することを確認した(図9右図)。
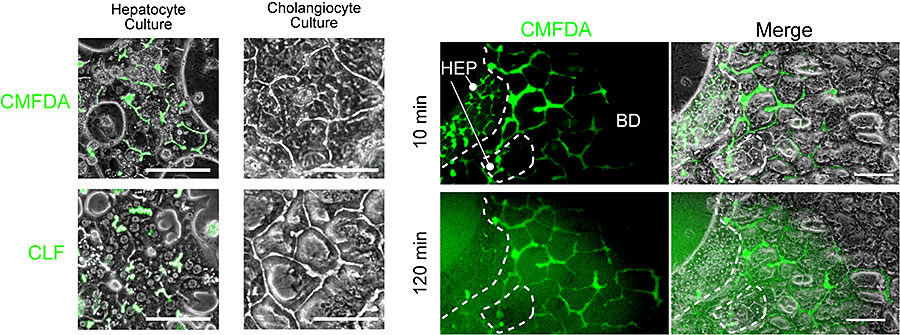
図9. CMFDAを培養液に添加し、代謝産物であるfluoresceinの毛細胆管への分泌と胆管への移行。
蛍光が付いた胆汁酸であるcholyl-lysine fluorescein(CLF)を投与したところ、肝細胞が取り込んだCLFが毛細胆管に分泌され、その後胆管へと輸送されることを確認した(図9左図と図10)。
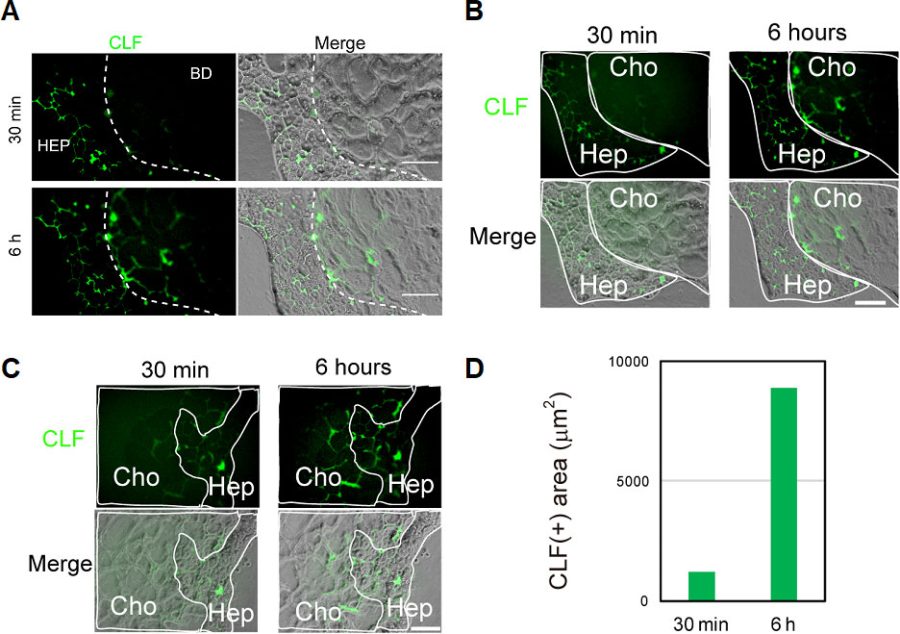
図10. HBTOにCLFを投与。CLF投与後30分間静置し、培養液を洗い流し、6時間後に蛍光顕微鏡で観察した。Scale bar: 100 μm
ビリルビンをHBTOに投与し、ビリルビン代謝物が胆管に排泄されるか検討した(図11)。酸化されたビリベルジンを胆管内に確認した。
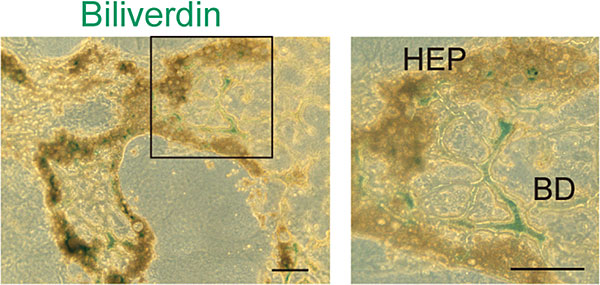
図11. ビリルビンを培養液に添加し、5日後にビリルビン染色をした。胆管内に緑色のビリベルジンを認める。右図は、左図の黒線で囲った部分の拡大図。Scale bar: 200 μm
HBTOを構成する肝細胞の機能をSHs由来肝細胞の単独培養と比較した。CYP3A4タンパク質の発現は、HBTOを構成する肝細胞のみ(図12A)で発現しており、CYP1A1及びCYP3A4活性は、共培養の方が有意に高かった(図12B)。HBTOにおけるCYP3A4活性は、初代培養肝細胞よりは低いがその1/3程度の活性を1ヶ月以上維持することが出来た(図12C)。
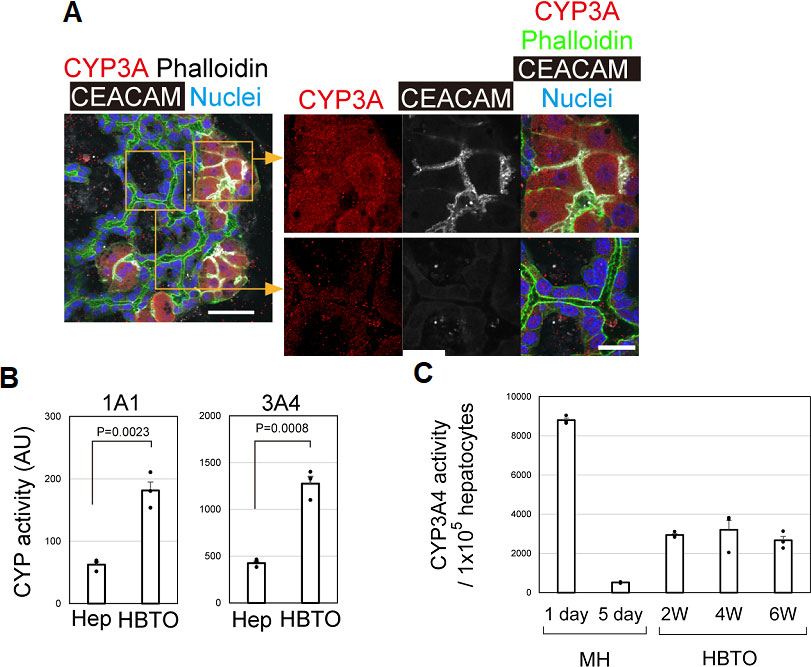
図12. HBTOにおける肝細胞の薬物代謝酵素であるCYP1A1及びCYP3A4の発現。CYP3A4の免疫染色像(A)。CYP1A1及びCYP3A4活性(B)と培養経過に伴う発現変化(C)。
HBTOを構成する細胞をソーティングして肝細胞(Hep)と胆管上皮細胞(Cho)の遺伝子発現をRT-qPCRで確認すると、Hnf4α 及びCypsの遺伝子発現は肝細胞に認められたが胆管上皮細胞には認められなかった(図13)。
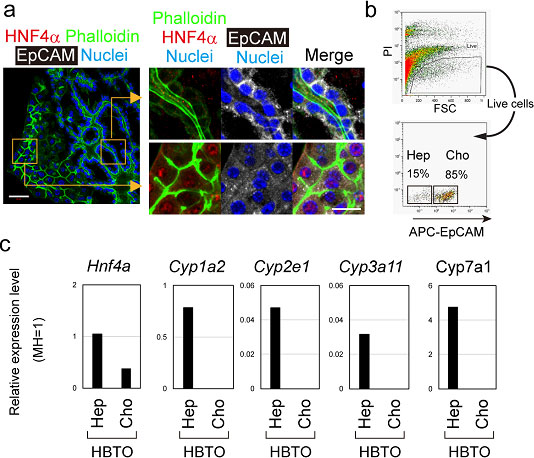
図13. HBTOを構成する細胞をソーティングして肝細胞 (Hep)と胆管上皮細胞 (Cho)の遺伝子発現。
BECsと共培養した肝細胞の細胞質にアルブミンを認めたがBECsには認められなかった(図14A)。BECsと肝細胞を共培養すると、アルブミンの分泌は共培養で有意に高く、単独で培養した場合より最大3倍多く産生した(図14B)。アルブミン分泌は培養経過と共に増加し、培養1ヶ月でピークとなりそのレベルを1ヶ月以上維持することが出来た(図14C)。
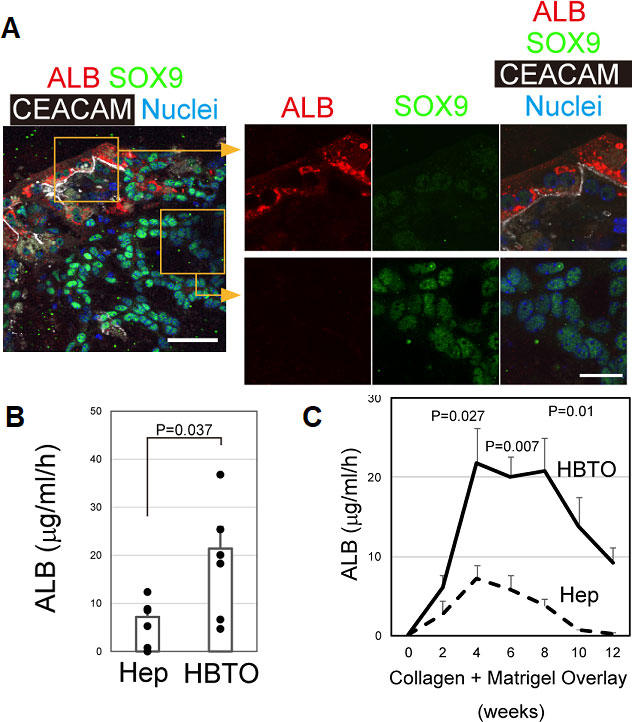
図14. HBTOの蛍光免疫染色像。CACAM陽性肝細胞の細胞質にAlbuminを認めるが、SOX9陽性BECsにアルブミンは発現していない(A)。Col-MG重層後4週間目のHBTO培養液中のアルブミン量(B)。Col-MG重層後最長12週間培養したHBTOのアルブミン分泌能(C)。
HBTOの培養液中にDil-low-density lipoprotein (Dil-LDL)を加えると、肝細胞にDil-LDLが取り込まれる(図15)。HBTOにおいて肝細胞機能が向上していることが分かった。

図15. Col-MG重層後4週間目に1時間Dil-LDLを投与し、蛍光顕微鏡で観察したDil-LDLを取り込んだ肝細胞の細胞質が赤色を呈する。
HBTOにおけるBECsの機能も検討した。
BECs特異的遺伝子の発現をRT-qPCRで確認した(図16a)。BECs単独培養の場合と遺伝子発現に有意さは認めなかった。
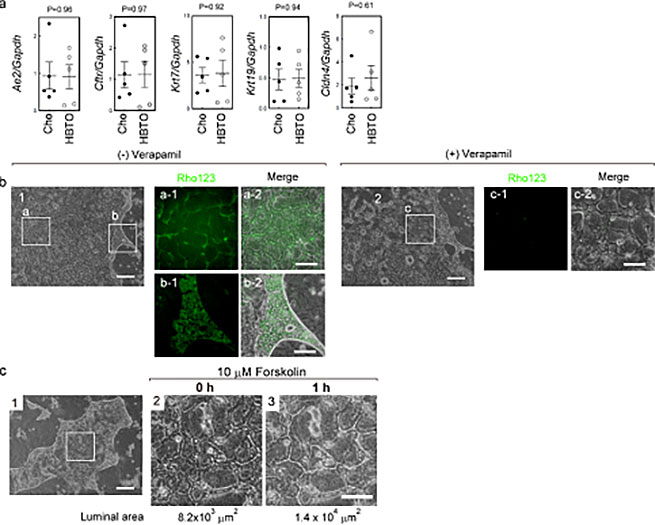
図16. Col-MG重層後4週目のHBTOにおけるBECsの機能。特異的遺伝子発現を4週間サンドイッチ培養したBECsとRT-qPCRを用いて比較した(a)。MDR阻害剤VerapamilによりRhodamine 123取り込み能の検討(b)。Forskolin投与による管腔拡大作用を検討。細胞間に形成される管腔の面積を計測した(c)。
Rhodamine123は、BECsに取り込まれた後、MDRを介して管腔に排出されることが知られている。HBTOにRhodamine123を添加すると肝細胞と胆管上皮細胞に取り込まれた。胆管では、Rho123の管腔への排出が見られたのに対し、肝細胞では細胞質にRho123がとどまっていた。MDR阻害剤であるverapamil投与したところ、胆管管腔への蓄積が阻害された(図16b)。また、細胞内cAMP量を増加させる作用のあるforskolinをCol-MG重層後4週間培養したHBTOに添加すると、胆管内腔の拡大が見られた(図16c)。
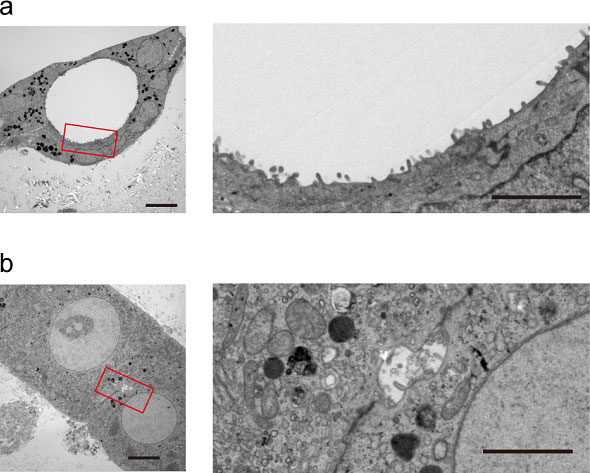
図17. HBTOを構成するBECs (a)と肝細胞 (b)の透過電子顕微鏡写真。Scale bars; 10 μm (左図), 5 μm (右図)
HBTOの微細構造を電子顕微鏡観察によって検討した。肝細胞間に形成された毛細胆管面やBECsのApical面には微絨毛は認めるが、鞭毛は認められなかった(図17)。
成熟肝細胞 (MHs)とBECsによりHBTOが作られるか検討すると、MHsはSHsほど効率よくHBTOを形成することが出きなかった(図18a)。SHsは典型的な肝細胞マーカーであるHnf4a, Cps1, Tdoを発現している(図18b)。SHsとMHsの遺伝子プロファイルをRNA sequence法を用いて検討した(図18c)。SHsとMHsの遺伝子発現はよく似ているが、SHsにおけるCypsとWnt signal pathwayの遺伝子発現はMHsより低かった(図18c)。
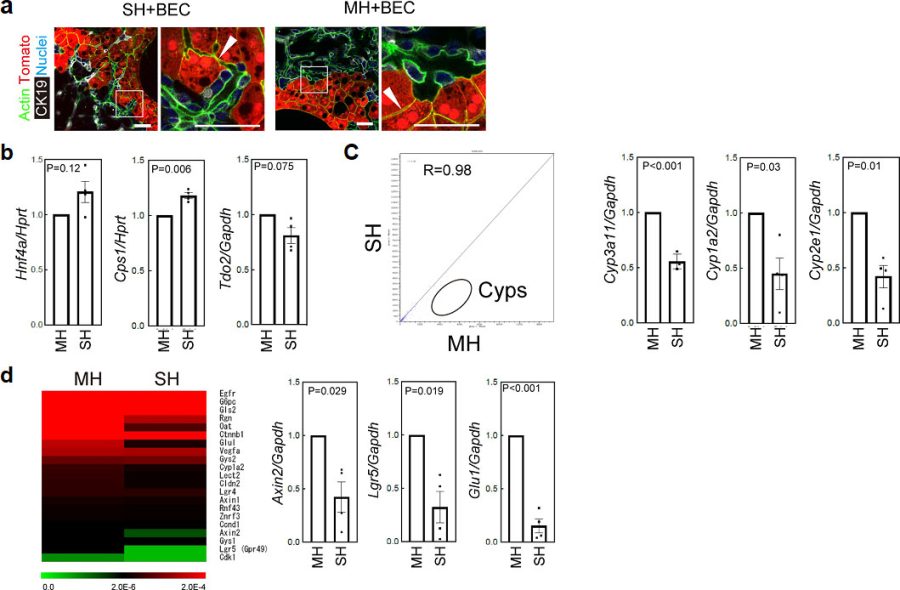
図18. tdTomato陽性肝細胞とBECsの共培養によるHBTO形成(a)。RT-qPCRによる肝特異的遺伝子の発現(b)。RNA sequenceによるSHsとMHsの遺伝子発現解析(c)。Wnt-target genesの比較(d)。
WNT/β-catenin signalはzone3で発現が強いことが知られている。WNT target genesであるGs, Lgr5, Axin2遺伝子の発現は、SHsで有意に低かった(図18d)。この結果は、SHsがZones 1& 2に存在する可能性を示している。
E-Cadherin (Ecad)はZones 1&2の肝細胞に発現されている一方、Claudin-2 (CLDN2)はZone 3の肝細胞に発現されていることが知られている。
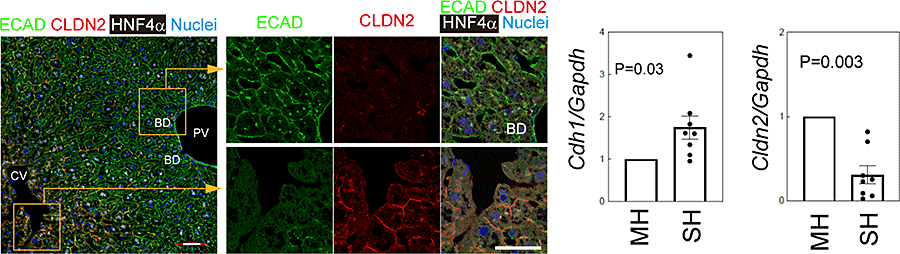
図19. Ecad及びCLDN2の肝組織における発現。
SHsのEcadの発現はMHsより高く、Cldn2の発現は低かった(図19)。
FACSによる解析結果も、SHsでEcadの発現が強く、MHsはECAD陽性及び陰性どちらの細胞も含んでいた(図20)。
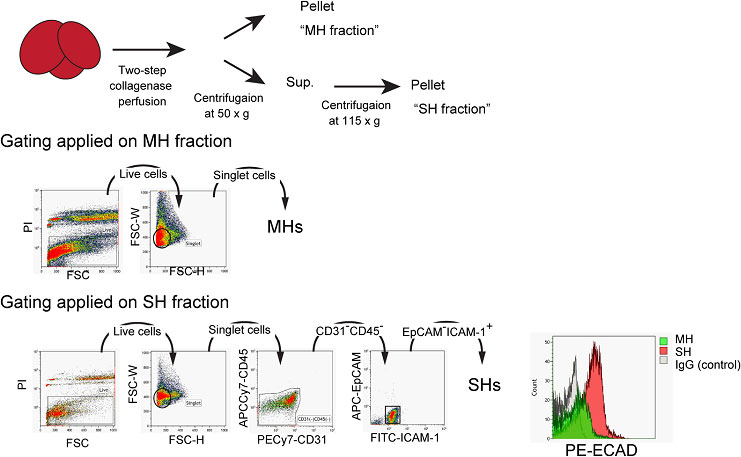
図20. 成熟肝細胞(MH)とSHsの単離によるECAD発現解析
ECAD+肝細胞とECAD–肝細胞を用いてBECsとの共培養によるHBTO形成効率を検討した(図21)。
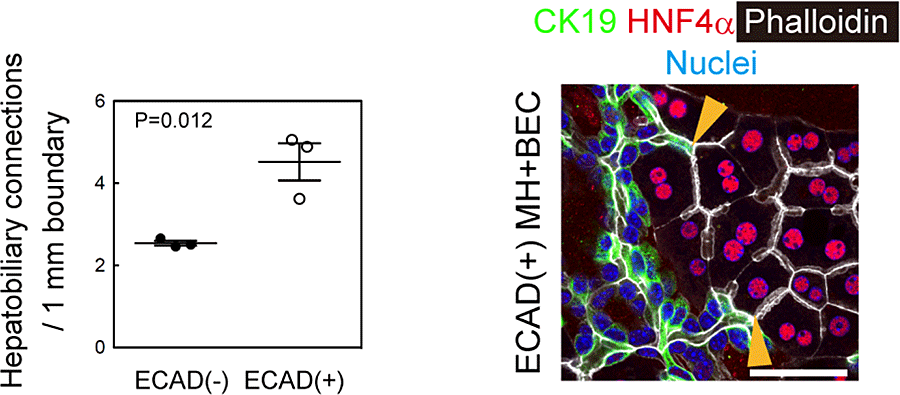
図21. ECAD陽性肝細胞とBECsによるHBTO形成。
これらの結果は、ECAD陽性肝細胞がよりHBTOを形成しやすいことを示している。
ヒト肝細胞由来細胞を用いて、HBTOが形成可能か検討した。Human reprogramming hepatocytes (hCLiP)は、単独で培養し、OSM刺激後にマトリゲルを重層することで、形態学的に肝細胞に相似した細胞に分化した。しかしながら、単独培養では毛細胆管を形成出来なかったが、tdTomato陽性マウスBECsと共培養すると毛細胆管を形成した(図22)。
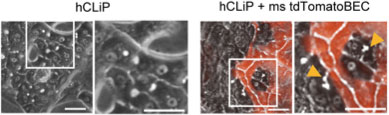
図22. hCLiPsの単独培養とtdTomato陽性マウスBECsとの共培養。矢頭は、毛細胆管を示す。Scale bars, 40 μm.
毛細胆管は胆管と結合していることが分かる。Hepatobiliary connectionの形成効率は、境界1 mm当たり2.1±0.1個であった(図23)。
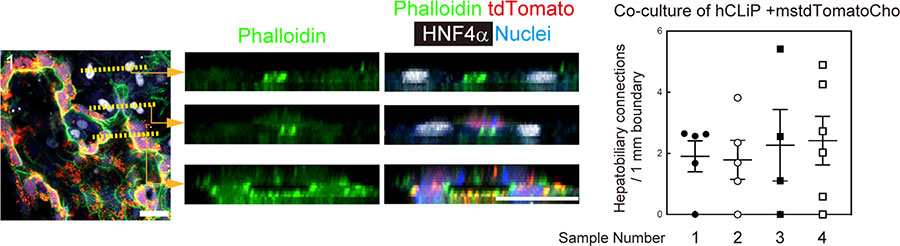
図23. hCLiPとtdTomato陽性BECsで構成されたHepatobiliary connection。右図は、その単位長当たりの形成数。
ヒト肝細胞とマウス胆管上皮細胞との共培養で得られたHybrid HBTOにおいても、機能的なHepatobiliary connectionが形成されているかを検討した。CLFを培養液中に添加して、胆汁酸が取り込まれfluoresceinがtdTomato陽性BECsからなる胆管に蓄積するか検討した(図24)。CLFの蓄積が、毛細胆管のみならず、胆管でも確認されたことから、Hybrid HBTOにおいても接続部構造が機能していることが分かった。
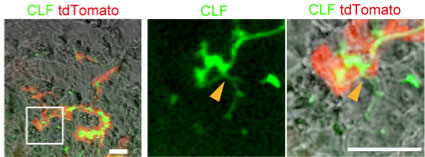
図24. hCLiPは取り込んだCLFを代謝しfluoresceinを毛細胆管に分泌し、tdTomato陽性BECsが形成する胆管内に蓄積される。矢頭は、Hepatobiliary connectionを示す。
Hepatobiliary connectionの形成は、Col-MG重層後の培養経過に伴い増加するのではなく1週後には既に完成していて4週経ってもその数に違いはなかった(図25)。しかしながら、HBTO内に形成される毛細胆管の長さが培養経過に伴い増加していた。
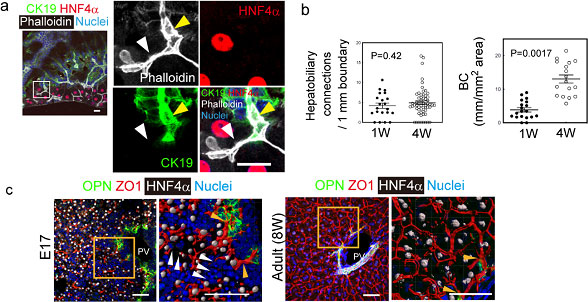
図25. HBTO及び肝発生におけるHepatobiliary connection形成のタイミング。Col-MG重層後1週目に形成されたHepatobiliary connection (a)。1週目と4週目におけるHepatobiliary connection の数と毛細胆管の長さ(b)。E17と8Wの肝組織におけるHepatobiliary connection (c)。
HBTOにおけるHepatobiliary connection形成は、胎仔期のhepatobiliary morphogenesisに似ている。E17の肝臓では、hepatobiliary connectionは既に形成されているが、肝細胞と胆管上皮細胞が集まったisletが散在性に存在し、毛細胆管は不連続である(図25c)。しかしながら生後の肝臓においては連続している。
したがって、HBTOは肝臓のhepatobiliary morphogenesisのモデルとしても利用できると考えている。
本研究のKey points
- コラーゲンゲルの濃度とMG添加量
- BECsとSHsの時間差をつけての共培養
- E-cadherin陽性肝細胞が胆管上皮細胞とHepatobiliary connectionを形成する。SHsはMHsより効率よくHepatobiliary connectionを形成出来るが、その理由の一つは、Ecad発現が高いためと考えられる。
- Col-MGを重層してからSHsは分化・成熟化が進行するが細胞死は見られない。4週目位にピークに達し、分化能は1ヶ月以上維持される。
- 培養液に添加された胆汁酸やビリルビンは、肝細胞内で代謝される。代謝産物は、毛細胆管に排泄され胆管に運ばれ蓄積される。
- 胆汁の負荷が軽減されることで肝細胞の機能が向上し維持される。
今後の課題
- 胆管に蓄積した胆汁の回収又は導出方法の確立
- 肝外胆管との接続の確立
- 肝組織内への移植方法の確立
- Hashimoto W, Sudo R, Fukasawa K, Ikeda M, Mitaka T, Tanishita K. Ductular network formation by rat biliary epithelial cells in the dynamical culture with collagen gel and dimethylsulfoxide stimulation. American Journal of Pathology, 173(2), 494-506 (2008) DOI: 10.2353/ajpath.2008.071024
- Tanimizu N, Nakamura Y, Ichinohe N, Mizuguchi T, Hirata K, Mitaka T. Hepatic biliary epithelial cells acquire epithelial integrity but lose plasticity to differentiate into hepatocytes in vitro during development. Journal of Cell Science, 126(Ppt22): 5239-5246 (2013) doi: 10.1242/jcs.133082
- Tanimizu N, Ichinohe N, Ishii M, Kino J, Mizuguchi T, Hirata K, Mitaka T. Liver progenitors isolated from adult healthy mouse liver efficiently differentiate to functional hepatocytes in vitro and repopulate liver tissue. Stem Cells, 34(12): 2889-2901 (2016) doi: 10.1002/stem.2457
- Tanimizu N, Ichinohe N, Sasaki Y, Itoh T, Sudo R, Yamaguchi T, Katsuda T, Ninomiya T, Tokino T, Ochiya T, Miyajima A, Mitaka T. Generation of functional liver tissue on combining hepatocytes and cholangiocytes with hepatobiliary connection ex vivo. Nature Communications, 2021 Jun 07; 12:3390 doi: 10.1038/s41467-021-23575-1



