(2)小型肝細胞
(2)-3 小型肝細胞の成熟化
小型肝細胞を培養すると、一個の肝前駆細胞から成熟肝細胞に分化し、3次元的な組織を形成するまでを一つの培養皿上でみることができる。特別な誘導因子を加えることなく、細胞自ら分泌する因子及び分離時に混入する非実質細胞の分泌する因子との相互作用により、肝組織に良く似た構造を構築する。我々が知る限り、これまで報告されている幹細胞・前駆細胞は、肝臓由来でないものも含めて細胞が自立的に分化し、組織化することは無い。外的に何らかの誘導因子が加えられるなど培養条件を途中で変えることで誘導を行っている。
正常成熟動物肝臓から分離した小型肝細胞を含む接着細胞分画の細胞(星細胞、肝上皮様細胞)による自立的組織形成過程を研究することにより、肝臓がどのような機序で組織形成をするのかを明らかにしたい。
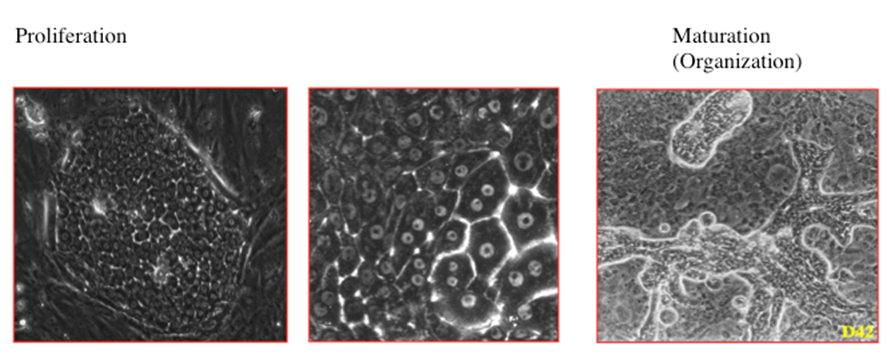
図1. 小型肝細胞は、10日目で約30個の細胞からなるコロニーを形成し、増殖を続ける。2週間ほど経つとコロニーの明らかに大型の形態学的には成熟肝細胞に極めて良く似た細胞が出現してくる。2核の細胞も認められるが、3核になることはほとんど無い。培養経過と共に大型化した細胞は、コロニーの上に盛り上がってくるようになる。盛り上がった細胞間には、毛細胆管が形成され、培養経過と共に索状に伸長するようになる。乳仔肝臓における肝細胞索に類似した構造である。
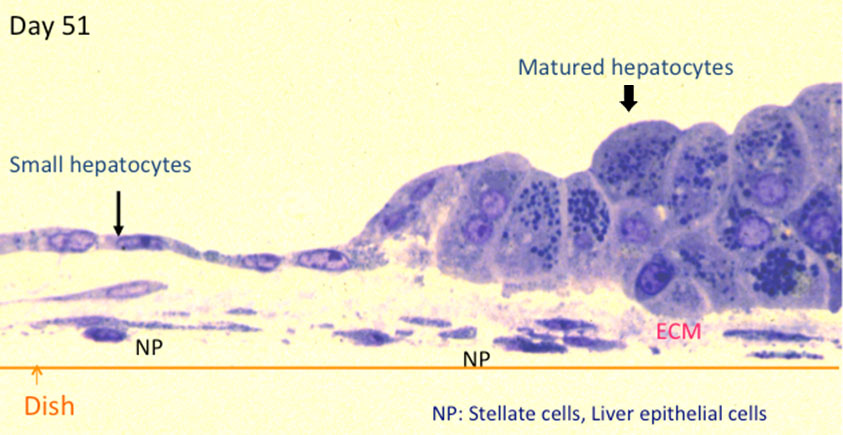
図2. 小型肝細胞コロニーの盛り上がった部分の縦断面(培養75日目)。透過電子顕微鏡写真を撮るために作ったsemi-thin sectionをトルイジン染色した。小型肝細胞(細い矢印)が急に大型の細胞(太い矢印)に変化していることがわかる。コロニーの下にNPC(矢頭)が潜り込み、2~3層に重なった大型細胞(太い矢印)との間に細胞外基質(ECM)が蓄積している。
(Mitaka T et al. Hepatology,1999)
細胞が盛り上がって形成された組織の縦断面をみると、細胞は大型化しており、超微形態学的にも細胞内小器官 (mitochondria, rER, glycogen granules, peroxisome)に富み、細胞間には毛細胆管が形成されている。また、大型化した肝細胞と培養皿面の間には、非上皮細胞(星細胞や肝上皮様細胞)が浸潤しており、それらの細胞と肝細胞の間には薄い基底膜様構造が認められる(図2)。
小型肝細胞の成熟化・組織化は、基底膜成分(Matrigel®)投与によっても誘導できることから、type IV collagen, lamininなどの細胞外基質が重要な働きをしていることが推測できる。しかしながら、それぞれ単独では組織化を誘導できないことから、肝細胞と非実質細胞が分泌する細胞外基質が相互作用して基底膜構造を構築することが組織化には重要であると考えられる。
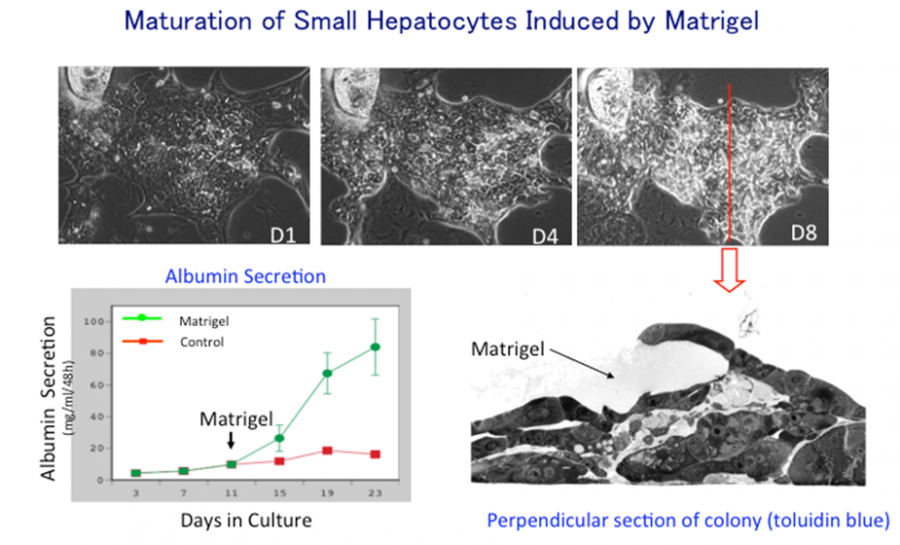
図3. 小型肝細胞コロニーを剥がして蒔き直し、Matrigelを投与した。小型肝細胞は大型化し、盛り上がってくる。Matrigel投与後、アルブミンの産生が著明に増加する。
(Sugimoto S et al. J Cell Biochem, 2002)
肝細胞機能を発揮するためには特定の転写因子が協働して作用することが必要である。肝細胞に特異的というわけではないがHepatocyte nuclear factor 4 (HNF4), HNF3 (Foxa A), One cut homeobox (HNF6), CCAAT/enhancer binding proteins (C/EBP)などの転写因子は、肝発生過程において、肝細胞で強く発現するようになる。肝芽細胞は、分化に従いHNF1α, HNF3β, HNF4α, HNF6, C/EBPαと発現し肝細胞に分化する。胆管細胞はHNF1β, HNF6が発現した時に分化が起こる.成熟肝細胞ではHNF4, C/EBPαが強く発現していることから成熟化のマーカーとして用いられる。一方、胆管上皮細胞ではHNF1β, Sox9の発現がマーカーとして用いられる。
小型肝細胞は、その形態に準じた転写因子の発現をする。小型のまま単層で増殖している状態では、HNF4αは発現しているが、HNF6, C/EBPαの発現は見られない。しかしながら、大型化し盛り上がった状態になると、HNF4αに加えてHNF6, C/EBPαを共に発現するようになる。
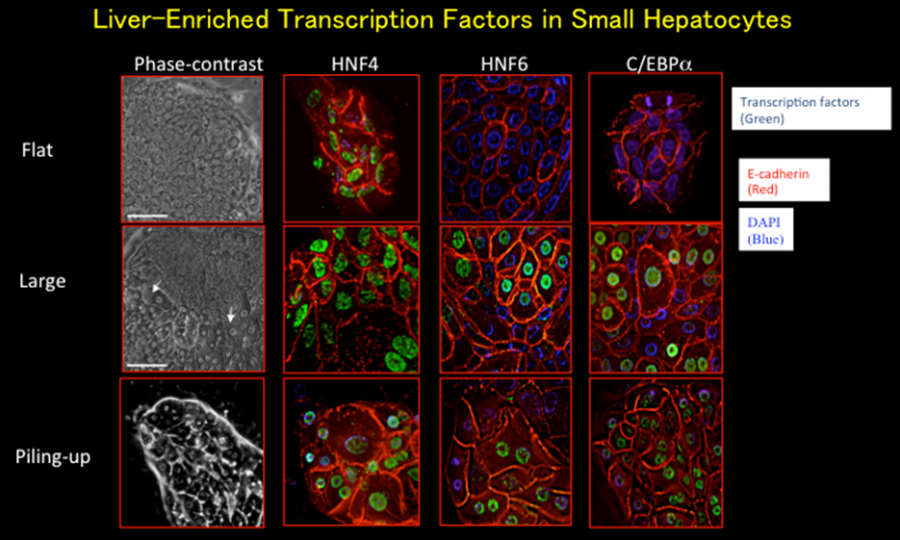
図4. 小型肝細胞の形態変化に伴う肝特異的転写因子HNF4α, HNF6, C/EBPαの発現変化。HNF4は、小型肝細胞に恒常的に発現しているが、HNF6とC/EBPαは小型肝細胞の成熟化に伴う大型化、3次元化した細胞に発現する。
(Sugimoto S et al. J Cell Biochem, 2002)
- 組織化した小型肝細胞コロニーの下には、星細胞(stellate cell)と肝上皮様細胞(liver epithelial cell)が浸潤している。
- 組織化したコロニーの下にはtype IV collagen, lamininが蓄積している
- 基底膜(basement membrane)形成が小型肝細胞の組織形成を誘導する
- l Mitaka T, Sato F, Mizuguchi T, Yokono T, Mochizuki Y. Reconstruction of hepatic organoid by rat small hepatocytes and hepatic nonparenchymal cells. Hepatology, 29(1), 111-125 (1999)
- Mitaka T, Sato F, Ikeda S, Sugimoto S, Higaki N, Hirata K, Lamers WH, Mochizuki Y. Expression of carbamoylphosphate synthetase I and glutamine synthetase in hepatic organoids reconstructed by rat small hepatocytes and hepatic nonparenchymal cells. Cell Tissue Res, 306, 467-471 (2001)
- Sugimoto S, Mitaka T, Ikeda S, Harada K, Ikai I, Yamaoka Y, Mochizuki Y. Morphological changes induced by extracellular matrix are correlated with maturation of rat small hepatocytes. J. Cell. Biochem.. 87(1), 16-28 (2002)
- Sudo R, Ikeda S, Sugimoto S, Harada K, Hirata K, Tanishita K, Mochizuki Y, Mitaka T. Bile canalicular formation in hepatic organoid reconstructed by rat small hepatocytes and nonparenchymal cells. J Cell Physiol, 199(2), 252-261 (2004)
- Miyamoto S, Hirata K, Sugimoto S, Harada K, Mitaka T. Expression of cytochrome P450 enzymes in hepatic organoid reconstructed by rat small hepatocytes. J. Gastroenterol. Hepatol., 20(6), 865-872 (2005)
- Ooe H, Kon J, Miyamoto S, Oozone Y, Ninomiya S, Mitaka T. Cytochrome P450 expressions of cultured rat small hepatocytes after long-term cryopreservation. Drug Metab Disposit, 34(10), 1667-1671 (2006)
- Oshima H, Kon J, Ooe H, Hirata K, Mitaka T. Functional Expression of Organic Anion Transporters in Hepatic Organoids Reconstructed by Rat Small Hepatocytes. J Cell Biochem, 104(1), 68-81 (2008)



