(3)オーバル細胞と小型肝細胞
肝再生時に出現するOval cellと小型肝細胞の関係
オーバル細胞は、形態学的には類似しているが表現型は一様ではなく、分化段階に幅のある細胞群と考えることができる。未熟な細胞から肝細胞や胆管細胞の特徴を強く持つ細胞まで含まれるが、どちらの細胞にも分化可能であることが重要である。
ガラクトサミン投与ラット肝臓においては、中心静脈周囲の肝細胞が壊死するが、門脈周囲領域に炎症細胞と共にオーバル細胞が出現する。その後にオーバル細胞と肝細胞の境界部に好塩基性の細胞質を持つ小型の肝細胞が出現し、それらの細胞は投与後7〜10日ほどで消失し、正常肝細胞に置き換わって再生が終了する(図1)。オーバル細胞は小型の肝細胞を介して成熟肝細胞に分化すると考えられてきた。我々は、この系で出現する小型の肝細胞と我々の見出した小型肝細胞(small hepatocytes)が同じ細胞であるとの仮説を立て、その検証とガラクトサミン投与ラット肝臓における再生機序を研究した。
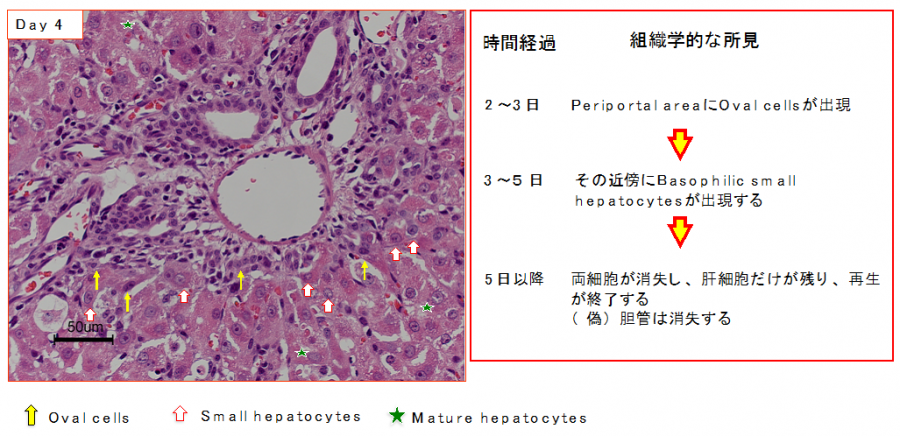
図1. d-Galactosamine投与後の肝再生。Oval cellsの出現と小型肝細胞の出現の時間軸と位置関係。
(Kon J,et al. J Hepatology, 2006)
オーバル細胞を同定するために表面マーカーの一つであるThy1を用いた。小型肝細胞のマーカーとしてCD44を用いた。ガラクトサミン投与後2日目にThy1陽性細胞が門脈周囲域に出現する。3日目に最大となり以後急速に減少する(図2)。一方、投与後3日目からThy1陽性細胞と肝細胞との境界領域にCD44陽性の肝細胞が多数認められ、4日目に最大となり以後徐々に減少する。Thy1/CD44両陽性の肝細胞も一過性に出現する。CD44陽性細胞は7日目にはほぼ消失し、炎症も治まりほぼ正常な肝小葉となる。この結果は、ガラクトサミン投与後の肝再生過程に出現する小型の肝細胞は、small hepatocytesと同じ表現型を持つ細胞で一過性に出現し成熟肝細胞に分化することを示している。
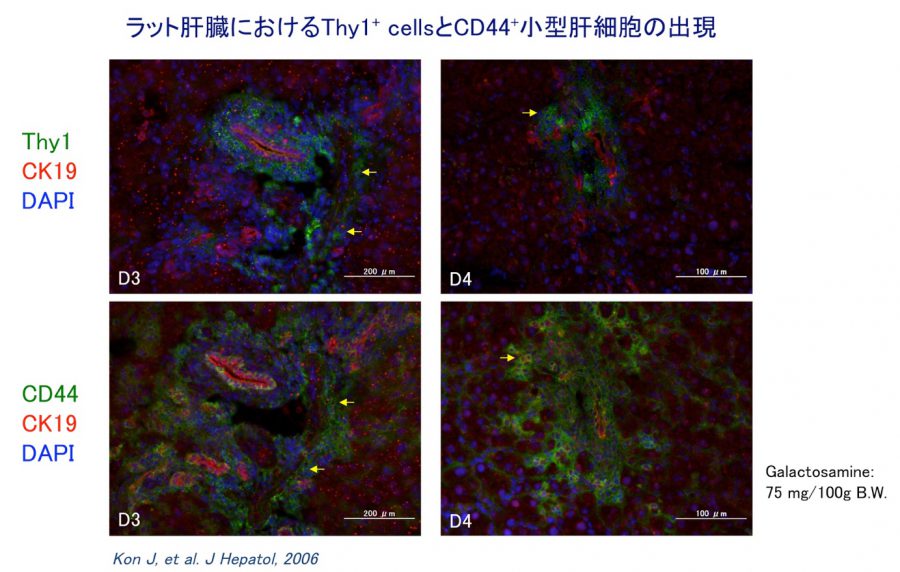
図2. d-Galactosamine(GalN)投与後の肝再生におけるThy1陽性細胞とCD44陽性細胞の出現。Thy1陽性細胞は、グリソン鞘内には筋線維芽細胞など多数存在しているが、GalN投与後 2日目にグリソン鞘周囲にも出現し、3日目に最大となり、以後著減し、5日目には消失。CD44陽性細胞は、胆管上皮細胞や血球系の細胞に発現しているが、GalN投与後3日目にグリソン鞘近傍の小葉内に出現する。4日目に最大となり、以後減少する。
(Kon J,et al. J Hepatology, 2006)
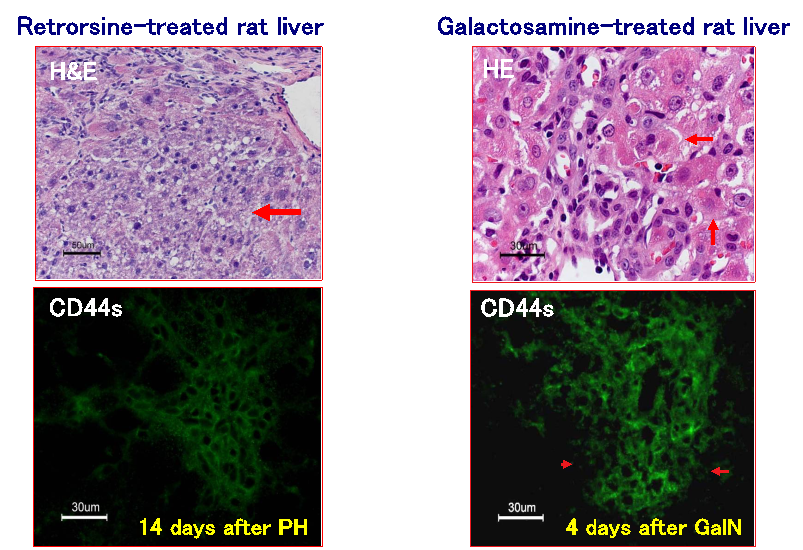
図3. 薬剤投与モデルラット肝臓に出現するCD44陽性小型肝細胞。
ガラクトサミン投与して2日目の肝臓から分離したThy1陽性細胞からは、CD44陽性小型肝細胞コロニーの形成は稀であったが、3日目からの細胞は多くのコロニーを形成した。薬剤投与後4日目の肝臓から分離したCD44陽性細胞は3日目から分離した細胞に比較して、より多くのコロニーを形成した。またThy1陽性細胞をコラーゲンゲル内で培養することで胆管を形成させることができた。分離した細胞の遺伝子発現を調べた結果、薬剤投与後2日目から分離したThy1陽性細胞は肝細胞を特徴付ける遺伝子をほとんど発現していないが、3日目から分離した細胞では、Thy1陽性細胞、CD44陽性細胞の順に肝細胞への分化が進んでいることがわかった(図4)。
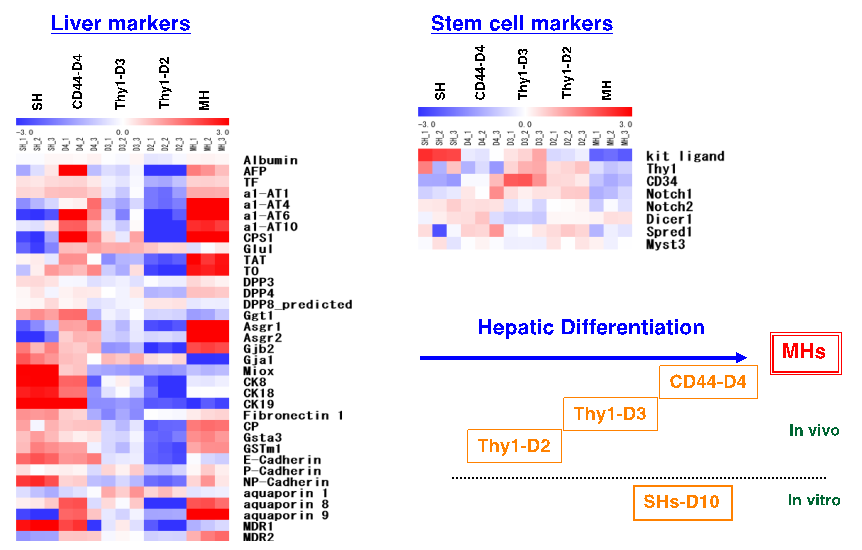
図4. ガラクサミン投与ラット肝臓から分離した細胞の肝分化関連遺伝子の発現をGeneChipを用いて解析した。2日目と3日目から分離したThy1陽性細胞、4日目のCD44陽性細胞、正常ラット肝臓から分離し10日間培養した小型肝細胞(SH)、成熟肝細胞を用いた。
(Kon J et al. Am J Pathol, 2009)
それぞれの細胞を肝臓に移植して肝細胞として生着し増殖するか調べると、Thy1, CD44, MHsの順に生着効率が高くなる。Thy1由来の細胞巣は移植後2ヶ月後には消失するが、移植したMHsは1年後もほぼ全て生存している。多くのCD44細胞は移植後2ヶ月を過ぎると消失していくが一部は長期に生存する。
CD44陽性肝細胞が成熟肝細胞に由来するのか、それともオーバル細胞が分化した細胞なのかについて、ガラクトサミン投与ラット肝臓からThy1, CD44陽性細胞を分離・培養し、検討した。2日目から分離したThy1陽性細胞は、EGF, HGF, aFGFによりCD44陽性細胞に誘導され、Matrigel投与により成熟化させることができる。しかしながら、Thy1陽性細胞から誘導されるCD44陽性肝細胞の少ない頻度を考慮すると、一過性に出現する小型肝細胞の多くは成熟肝細胞由来である考えるのが好ましく、また一見成熟化し既存の肝細胞と共存するかのように振る舞うが、生体が危急の状態から脱するとともに消失していく運命にあるのではないかと考えられる。
これらの結果は、ガラクトサミン障害肝の再生において出現するオーバル細胞の一部は、CD44陽性小型肝細胞を介して肝細胞に分化するが、その多くは既存の肝細胞が正常化するに従い不要となり消失していくことを示唆している。
- l Kon J, Ooe H, Oshima H, Kikkawa Y, Mitaka T. Expression of CD44 in rat hepatic progenitor cells. J Hepatology, 45(1), 90-98 (2006)
- Kon J, Ichinohe N, Ooe H, Chen Q, Sasaki K, Mitaka T. Thy1-positive cells have bipotential ability to differentiate into hepatocytes and biliary epithelial cells in galactosamine-induced rat liver regeneration. Am J Pathol, 175(6): 2362-2371 (2009)
- Ichinohe N, Kon J, Sasaki K, Nakamura Y, Ooe H, Tanimizu N, Mitaka T. Growth ability and repopulation efficiency of transplanted hepatic stem, progenitor cells, and mature hepatocytes in retrorsine-treated rat livers. Cell Transplantation, 21(1): 11-22 (2012)
- Ichinohe N, Tanimizu N, Ooe H, Nakamura Y, Mizuguchi T, Hirata K, Kon J, Mitaka T. Differentiation capacity of hepatic stem/progenitor cells isolated from d-galactosamine-treated rat livers. Hepatology, 57(3): 1192-1202 (2013)



